VĚDA A PROJEKTY LABORATOŘE
Proč octomilka?
Muška octomilka (latinsky Drosophila melanogaster) je jeden z nejlepších modelových organismů, který mají vědci k dispozici. Je to dáno jejím více než stoletým používáním ve vědě, jednoduchostí a rychlostí jejího chovu, možností snadné manipulace její genetické informace (doslova můžeme vypínat a zapínat kterékoliv geny kdy a kde chceme) a také její relativní jednoduchostí. Například oproti myši, která je také skvělým modelovým organismem a která je lidskému organismu mnohem podobnější, je většina biologických dějů u octomilky nepoměrně jednodušeji organizována a tudíž snáze zkoumatelná.
Molekulární integrativní fyziologie octomilky
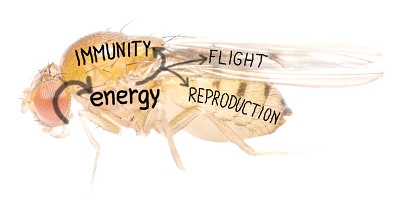
Aby organismus dobře fungoval v neustále měnících se podmínkách, je potřeba, aby jednotlivé systémy a orgány v těle spolu komunikovaly a přizpůsobovaly své chování aktuálnímu stavu organismu. A právě to zkoumá odvětví biologie zvané integrativní fyziologie, která se snaží popsat, jakým způsobem se integrují různé informace o aktuálním stavu organismu do změn ve fungovaní jednotlivých orgánů, systémů i celého těla. Signály a regulátory, které toto vše ovlivňují, jsou molekulární povahy, proto je potřeba při jejich zkoumání využít nejrůznější přístupy molekulární biologie. Základem pro zkoumání je mít dobrý modelový systém, který se dá studovat na úrovni celého organismu. A je potřeba mít možnost ten modelový systém manipulovat, například vypnout vybraný signál, abychom se o chování toho systému dozvěděli více, než pouhým popisem jeho chování za normálních okolností. A toto vše nám poskytuje model octomilky – možnost studovat celý organismus v určité situaci a snadno geneticky manipulovat konkrétní geny a tak ovlivňovat studované děje.
Náš model odhalil sobecké (nadřazené) chování imunitního systému
Jedním ze systémů, který je zásadní pro přežití organismu, je imunitní systém. Když se tento systém aktivuje, například při napadení organismu nějakým patogenem, může najednou vyžadovat poměrně velké množství energie, a to ovlivní celý organizmus. Pro studium regulací energie během imunitních reakcí využíváme octomilku jako modelový organizmus:
Jakými molekulárními mechanismy se v organismu zajistí dostatečný přísun energie pro právě probíhající imunitní reakci?

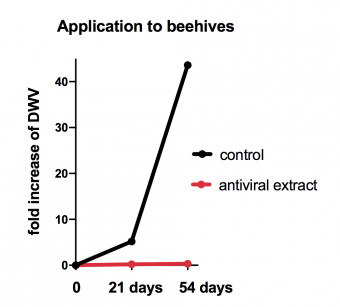
Při studiu úlohy extracelulárního adenozinu jsme zjistili, že adenozin dokáže při imunitní reakci tlumit spotřebu energie všemi ostatními tkáněmi v napadeném organismu s výjimkou imunitního systému. Tím zajistí dostatečný přísun energie pro imunitní buňky, které při své aktivaci vyžadují více energie. K tomu jsme využili infekci larev octomilky parazitoidní vosičkou.
Vosička je takový vetřelec v hmyzím světě, kdy klade svá vajíčka do larev například octomilky, z vajíčka se vyklube larva vetřelce, která doslova zkonzumuje vnitřek pozdější kukly octomilky a namísto dospělé mouchy octomilky se z kukly vyklube vetřelec jako dospělá parazitoidní vosička, připravená na další útok. Ovšem napadaná larva octomilky má možnost se bránit a zničit vajíčko vetřelce a to rychlou produkcí speciálních imunitních buněk, tzv. lamelocytů, které vajíčko obalí a zničí. Tato imunitní reakce ale musí být dostatečně rychlá a efektivní a právě proto se stala výborným modelem pro naše studium regulací energie při imunitní reakci.
Zjistili jsme, že je to právě adenozin, který tlumí spotřebu energie ostatními tkáněmi, aby bylo dost energie na rychlou produkci lamelocytů. Když jsme geneticky vypnuli signalizaci adenozinem v celém těle larvy octomilky (mutací receptoru pro adenozin AdoR), tak larva neutlumila spotřebu energie, té se pak nedostávalo imunitnímu systému, ten se stal zoufale neefektivním a larvička svůj boj s vetřelcem skoro vždy prohrála. Pro studium distribuce energie jsme mimo jiné použili radioaktivně značenou glukózu, která nám umožnila měřit množství přijaté glukózy jednotlivými tkáněmi.
Když jsme se dále ptali, které buňky produkují adenozin jako signál, který je schopen takto utlumit celý organizmus, genetickými nástroji jsme vypnuli transportér pro adenozin pouze v imunitních buňkách. Tím jsme zjistili, že to jsou právě imunitní buňky, který tento signál vypouští a tak jsme prokázali sobeckost imunitního systému, nebo chcete-li jeho nadřazenost nad zbytkem organismu během probíhající imunitní reakce. Tímto chováním (např. vyplavením adenozinu) si imunitní systém zajistí dostatečný přísun energie a tím efektivní imunitní reakci. V tomto případě je toto chování v zájmu celého organismu a tudíž nadřazenost je trefnějším výrazem. Stejné chování ovšem může být příčinou mnoha patologií, spojených s dlouhotrvající, chronickou aktivací imunitního systému (různá chronická zánětlivá onemocnění, jako revmatoidní artritida) a v tu chvíli je asi výstižnější mluvit o sobeckém imunitním systému (teoretický koncept popsal Dr. Reiner Straub).
Výsledky této práce byly publikovány v časopise PLoS Biology:

Imunitní buňky dokážou utlumit zpět své vlastní nadřazené chování
Nadřazenost imunitního systému je životně důležitá při akutním ohrožení organizmu, ale dříve či později je třeba toto chování zase utlumit, aby se nadřazenost nestala sobeckostí (jako je tomu u příliš dlouho aktivované imunity) a nedošlo k vyčerpávání organizmu. Jak je to zařízeno ukázal náš další model aktivace imunitní reakce, a to bakteriální infekcí dospělých octomilek. Při nich napíchneme přesně definované množství bakterií (např. streptokoka nebo listerie) do těla octomilky. Při studiu těchto reakcí jsme zjistili, že opět samotné imunitní buňky produkují v pozdější fázi imunitní reakce enzym, který snižuje množství adenozinu a tak potlačuje jeho efekty na energetický metabolizmus mouchy. Když jsme geneticky potlačili fungování tohoto enzymu, tak to sice krátkodobě mohlo pomoci octomilce bojovat se streptokokem, ale za cenu většího vyčerpání energetických zásob. Dlouhodoběji to ale spíše muškám škodilo a při chronické infekci listerií to vedlo ke kratšímu životu a naopak to prospívalo bakteriím, které se pravděpodobně dostali k většímu množství živin na úkor hostitele.
Výsledky této práce byly publikovány v časopise PLoS Pathogens:

O výsledcích tohoto výzkumu hovořil Tomáš Doležal 21.5.2018 v České Televizi ve Studiu 6.
Publikace laboratoře
- Doležal T. (2023) How to eliminate pathogen without killing oneself? Immunometabolism of encapsulation and melanization in Drosophila. Frontiers in Immunology. DOI: 10.3389/fimmu.2023.1330312
- McMullen E, Strych L, Chodáková L, Krebs A, Dolezal T. (2023) JAK/STAT mediated insulin resistance in muscles is essential for effective immune response. Preprint available: https://doi.org/10.1101/2023.10.04.560867
- Kazek M, Chodáková , Lehr K, Strych L, Nedbalová P, McMullen E, Bajgar A, Šimek P, Moos M, Doležal T. (2023) Metabolism of glucose and trehalose by cyclic pentose phosphate pathway is essential for effective immune response in Drosophila. Preprint available: https://doi.org/10.1101/2023.08.17.553657
- Krejčová G, Morgantini C, Zemanová H, Lauschke, VM, Kovářová J, Kubásek J, Nedbalová P, Kamps‐Hughes N, Moos M, Aouadi M, Doležal, T and Bajgar A. (2023) Macrophage‐derived insulin antagonist ImpL2 induces lipoprotein mobilization upon bacterial infection. The EMBO Journal. https://doi.org/10.15252/embj.2023114086
- A Bajgar, G Krejčová, T Doležal (2021) Polarization of Macrophages in Insects: Opening Gates for Immuno-Metabolic Research. Front Cell Dev Biol, 15 February 2021 | https://doi.org/10.3389/fcell.2021.629238 (IF=5.2)
- Doležal T, Nedbalová P, Krejčová G, Kazek M, Lehr K, Chodáková L, Strych L, Dolejšková T, Bajgar A (2020) Privileged immune cell upon activation – how it changes its own metabolism and metabolism of the whole organism. figshare POSTER DOI: 10.6084/m9.figshare.12144831.v1
- Krejcova G, Danielova A, Nedbalova P, Kazek M, Strych L, Chawla G, Tennessen JM, Lieskovská J, Jindra M, Dolezal T, Bajgar A (2019) Drosophila macrophages switch to aerobic glycolysis to mount effective antibacterial defense. eLife 14;8. pii: e50414. doi: 10.7554/eLife.50414. (IF=7.5)
- Bajgar A, Salon I, Krejcová G, Dolezal T, Jindra M, Stepanek F (2019) Yeast glucan particles enable intracellular protein delivery in Drosophila without compromising the immune system. Biomater Sci 30. doi: 10.1039/c9bm00539k. (IF=5.2)
- Morgantini C, Jager J, Li X, Levi L, Azzimato V, Sulen A, Barreby E, Xu C, Tencerova M, Näslund E, Kumar C, Verdeguer F, Straniero S, Hultenby K, Björkström NK, Ellis E, Rydén M, Kutter C, Hurrell T, Lauschke VM, Boucher J, Tomčala A, Krejčová G, Bajgar A, Aouadi M (2019) Liver macrophages regulate systemic metabolism through non-inflammatory factors. Nat Metab 1, 445–459 doi:10.1038/s42255-019-0044-9
- Mihajlovic Z, Tanasic D, Bajgar A, Perez-Gomez R, Steffal P, Krejci A (2019) Lime is a new protein linking immunity and metabolism in Drosophila. Dev Biol. 452(2):83-94. doi: 10.1016/j.ydbio.2019.05.005. (IF 2.9)
- Dolezal T, Krejcova G, Bajgar A, Nedbalova P, Strasser P (2019) Molecular regulations of metabolism during immune response in insects. Insect Biochem Mol Biol 109:31-42. doi: 10.1016/j.ibmb.2019.04.005 (IF=3.9)
- Bajgar A, Dolezal T (2018) Extracellular adenosine modulates host-pathogen interactions through regulation of systemic metabolism during immune response in Drosophila. PLoS Pathog 14(4): e1007022 (IF=6.6)
- Dolezal T (2015) - Adenosine: a selfish-immunity signal? Oncotarget - Immunology and Microbiology Section 6 (32), 32307-32308 (IF=6.3)
- Bajgar A, Kucerova K, Jonatova L, Tomcala A, Schneedorferova I, Okrouhlik J, Dolezal T (2015) Extracellular Adenosine Mediates a Systemic Metabolic Switch during Immune Response. PLoS Biol 13(4): e1002135 (IF=11.8)
- Novakova M and Dolezal T (2011). Expression of Drosophila adenosine deaminase in immune cells during inflammatory response. PLoS ONE 6(3): e17741 (IF=3.2)
- Fenckova M, Hobizalova R, Fric Z, Dolezal T (2011). Functional characterization of ecto-5’-nucleotidases and apyrases in Drosophila melanogaster. Insect Biochem Mol Biol 41(12): 956-967 (IF=3.4)
- Zuberova M, Fenckova M, Simek P, Janeckova L, Dolezal T (2010). Increased extracellular adenosine in adenosine deaminase deficient flies activates a release of energy stores leading to wasting and death. Dis Model Mech 3(11-12): 773-84 (IF=4.9)
- Dolezal T, Kucerova K, Neuhold J, Bryant PJ (2010). Casein kinase I epsilon somatic mutations found in breast cancer cause overgrowth in Drosophila. Int J Dev Biol 54: 1419 – 1424 (IF=2.8)
- Foldynova-Trantirkova S, Sekyrova P, Tmejova K, Brumovska E, Bernatik O, Blankenfeldt W, Krejci P, Kozubik A, Dolezal T, Trantirek L, Bryja V. (2010). Breast cancer specific mutations in CK1epsilon inhibit Wnt/beta-catenin and activate Wnt/Rac1/JNK and NFAT pathways to decrease cell adhesion and promote cell migration. Breast Cancer Res 12(3): R30 (IF=5.5)